01 直播前言
伴随着科学技术的不断提高,信息技术得到了大面积的推广,计算机系统的使用令各个行业都发生了翻天覆地的改变。对于制药企业来说,信息化技术优化了工作方式,提高了工作人员的工作准确度与工作效率。但是伴随着变革,数据完整性的考验也成为了当前面临的主要问题。对于制药企业而言,数据完整性可以算是GMP最基本的要求。只有确保了数据的完整性,才能确保数据管理零风险,确保制药企业的正常运行。

02 数据完整性定义
数据完整性指的是在药品整个生命周期中,包括药品研发、生产以及上市后的监测,相关的数据和记录要符合数据完整性要求。

03 数据完整性的法规指引
数据完整性相关法规包括两个部分:法规和规章、行业技术指南。无论欧盟EMEA、美国FDA、还是中国CFDA,关于药品GMP规范的总体原则是一样的,但整体来讲,我们的指南,在数量、内容、技术深度上,与欧美还是存在一定差异。”在国外(美国、欧盟等),往往由企业和行业协会推动标准升级,发布技术指南,推动行业进步和技术发展,而中国,往往由监管部门推动标准升级,企业相对处于被动接受地位。
数据完整性相关方面,PDA、ISPE、WHO近些年有很多指南。关于数据跟记录的管理规范,MHRA在2015年发布了指南(2016年进行更新),WHO和FDA发布了草稿。
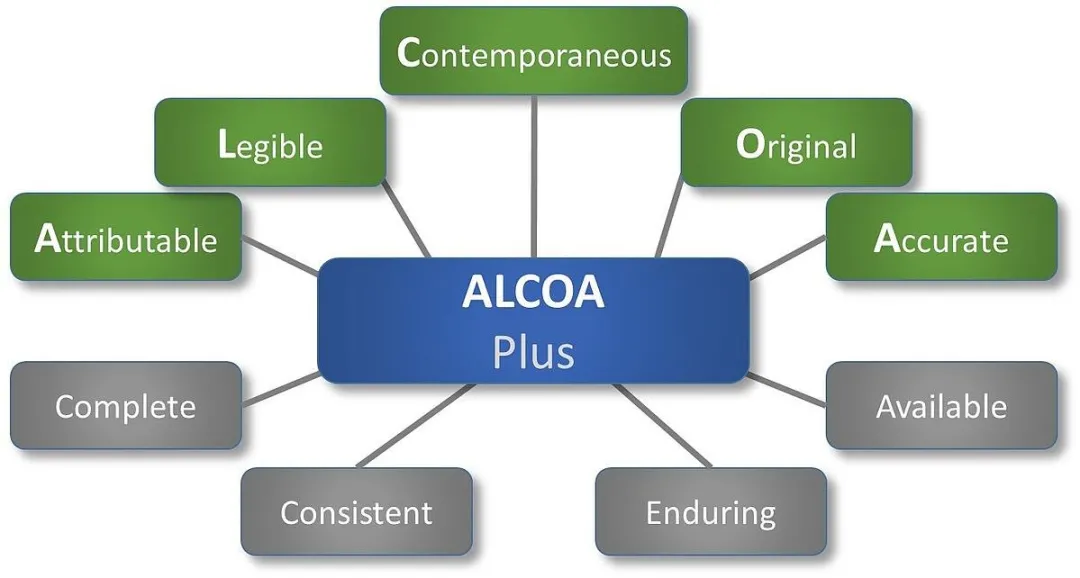
04 数据完整性的原则
目前被公认的数据完整性的原则是ALCOA+原则,即ALOCA+CCEA原则,其具体释义如下:
Attributable:可追溯的,记录可追溯
Legible:清晰的,可见
Contemporaneous:同步的,与操作同步生成/录入
Original:原始的数据,未经转手的
Accurate:准确的,与实际操作相一致的,无主观造假或客观输入错误
Complete:完整的,无遗漏
Consistent:一致的,与实际生成逻辑顺序一致, 显示的记录人同实际操作者一致
Enduring:长久的,耐受的原始数据长久保存,不易删除,丢弃
Available:可获得的数据在审计时可见,不被隐藏
05 适用对象
• 质量管理人员
• 验证管理人员
• 工程管理人员
• 生产管理人员
06 预约进入直播间
本次课程非全网直播,如您感兴趣可扫描下面二维码登录并审核后获得锁定进入直播间的资格:

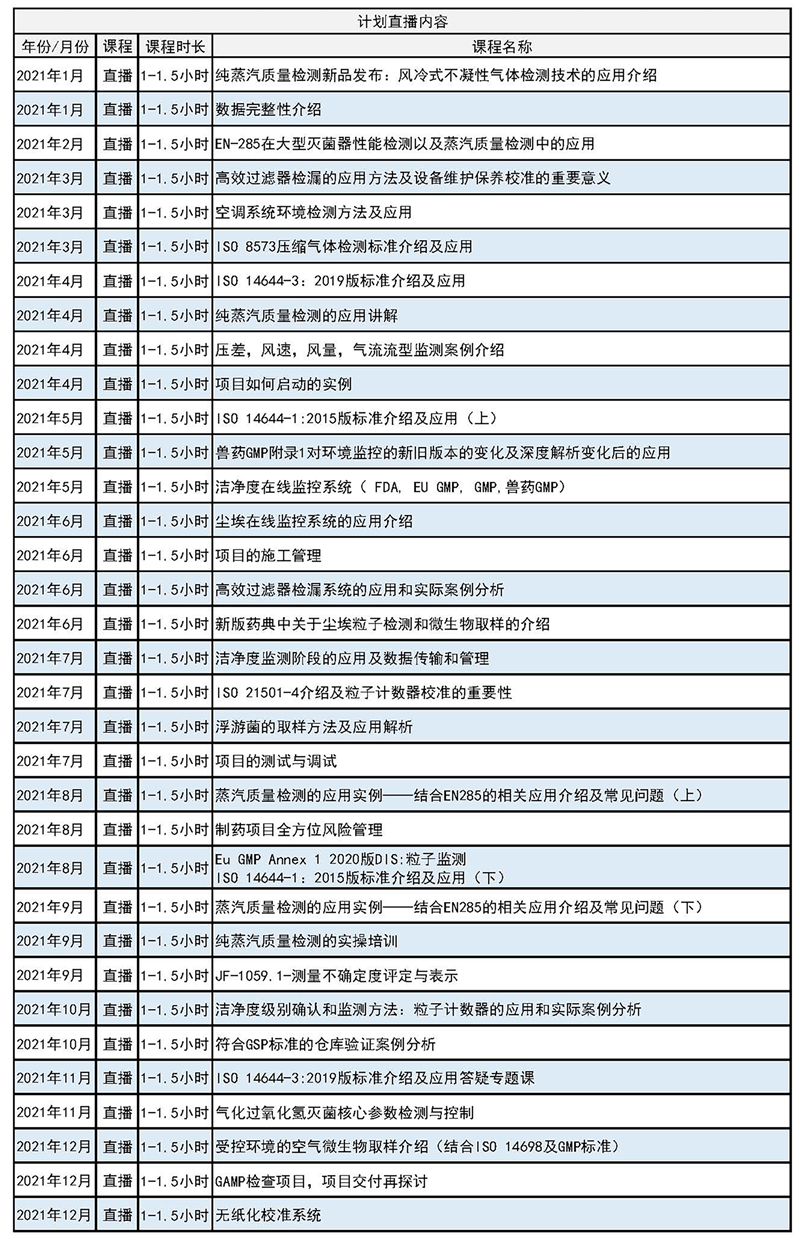
感谢您一直的支持,我们也会把多年的国内外交流经验及专业的专家团内部研讨并汇总的精华内容分享给大家。分别呈现在后期不同课程中,课程预告如下:后期直播课课表(计划内容可能存在微调,计划时间:晚7:55开始,课程时长1-1.5小时)